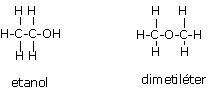|
|||||||||||||||||||||
|
Questões:
|
Química
- Grupo 1
Valor: 4,0 pontos A) Um reator foi projetado para operar em temperatura de 127 °C e suportar altas pressões gasosas. Por questões de segurança, foi instalada uma válvula de alívio, que abre quando a pressão ultrapassa 10 atm. Calcule o volume deste reator sabendo que o mesmo tem capacidade para conter 5 mols de nitrogênio nestas condições.
Resposta 16,4L Aplicando-se ao nitrogênio a equação dos gases PV = nRT obtém-se
onde n = 5 mol R = 0.082.L .atm. mol-1. K-1 T = 273 + 127 = 400 K P = 10 atm.
B) Uma amostra de gás, a 327 °C e 120 atm de pressão, ocupa um recipiente de 10 L. Qual a variação de temperatura que se deve efetuar para que a pressão seja de 20 atm quando se transferir este gás para um recipiente de 40 L ?
Resposta A variação de temperatura deve ser de 200 K (ou 200 °C) Voltando a aplicar a equação dos gases, considerando que a quantidade de gás não se altera ao transferi-lo de recipiente, escreve-se
donde se obtém, para a temperatura final,
A variação de temperatura dever ser
Valor: 4,0 pontos O sulfeto de hidrogênio, produzido pela decomposição
da matéria orgânica, é transformado em dióxido
de enxofre na atmosfera pela reação: A) Quantos gramas de O2 são necessários para reagir com 1 mol de H2S?
Resposta Para reagir com 1 mol de H2S são necessários 48 g de O2(g) 3 mol de O2 (g) reagem com
2 mol de H2S (g) \
com 1 mol de H2S (g) , reagem 1,5 mol de
O2 (g)
B) O dióxido de enxofre continua a ser
oxidado pelo oxigênio atmosférico formando o trióxido
de enxofre:
Sabendo-se que a pressão de O2 (g)
é menor na cidade do México do que no Rio de Janeiro,
devido à altitude da cidade do México em relação
ao nível do mar, pergunta-se:
Resposta A maior formação de SO2(g) será na cidade do Rio de Janeiro. Pelo princípio de Le Chatelier, a maior pressão de O2 favorece o deslocamento no sentido da formação de SO3. Logo, na cidade do Rio de Janeiro haverá maior formação de SO3 (g).
C) O trióxido de enxofre, por sua vez, reage com a água (umidade do ar), produzindo ácido sulfúrico, um dos principais responsáveis pelo fenômeno da chuva ácida que causa uma série de problemas no meio ambiente. SO3 (g) + H2O (l) --> H2SO 4 (l)
Sabendo-se que o H2SO4 é um ácido forte e dissocia-se em solução aquosa como: H2SO4(aq) <--> 2 H+(aq) + SO42-(aq) ,
qual o pH de uma solução contendo 2,5 x 102 mols de H2SO4 em 500 mL de H2O ?
Resposta pH = 1 [H2SO4] = 2,5.10-2 mol / 0,5 L = 5.10-2 M Pela dissociação: 1 H2SO4 ® 2 H+ Logo, a [H+] = 2 x 5.10-2 = 10-1 M Como pH = -log [H+] pH = - log10-1 pH = 1
Valor: 2,0 pontos O dimetiléter tem seu peso molecular igual a 46 e ponto de ebulição igual a -25 °C. O álcool etílico (etanol) tem o mesmo peso molecular, mas um ponto de ebulição bem mais alto, igual a 78,3 °C. Apresente a fórmula estrutural de cada um dos compostos e, através delas, explique a grande diferença dos seus pontos de ebulição. Observação: A fórmula molecular para ambos os compostos é C2H6O
Resposta A fórmula estrutural dos compostos é Como se pode ver, o etanol tem um grupamento OH que permite a formação de ligações de H entre as moléculas, o que explica o ponto de ebulição mais elevado.
|
||||||||||||||||||||