|
|||||||||||||||||||||||||||||||||||||||
|
Questões:
|
Química
- Grupo 3
Considere as afirmações sobre elementos do grupo IA da
Tabela Periódica:
Resposta C) I, II e IV. A afirmação III é falsa porque o potencial de ionização diminui com o número atômico.
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30
Um pneu de bicicleta é calibrado a uma pressão de 4 atm
em um dia frio, à temperatura de 7 °C. Supondo que o volume
e a quantidade de gás injetada são os mesmos, qual será
a pressão de calibração nos dias em que a temperatura
atinge 37 °C ?
Resposta B) 4,4 atm Aplicando a equação dos gases às duas situações obtém-se
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 Após o preparo de um suco de fruta, verificou-se que 200 mL
da solução obtida continham 58 mg de aspartame. Qual a
concentração de aspartame, no suco preparado?
Resposta A) 0,29 g/L se temos 58 mg de aspartame em 200 mL de suco, então devemos ter x mg de aspartame em 100 mL de suco. Logo,
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30
Uma das características das últimas décadas foram
as crises energéticas. Neste contexto, tivemos várias
notícias nos jornais relacionadas com diferentes formas de geração
de energia. As afirmativas abaixo poderiam ter constado de algumas dessas
matérias: Dentre as afirmações acima, apenas está(ão)
correta(s):
Resposta D) II e IV. A afirmativa I está errada porque um reator utiliza a fissão e não a fusão nuclear. A afirmativa III está errada porque a energia liberada numa fissão nuclear é milhões de vezes maior do que a energia liberada na queima (uma reação química) do carvão.
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30
25 O3(g)+ C2H4(g) --> 2 CH2O(g) + O(g) Num ambiente com excesso de O3(g), quantos mols de etileno
são necessários para formar 10 mols de formaldeído?
Resposta B) 5 mols Como se pode deduzir da equação mostrada,
se 1 mol de etileno forma 2 mol de formaldeido; logo, então,
x mol de etileno formam 10 mol de formaldeído.
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 A cloração é um dos processos de desinfecção
de águas de abastecimento doméstico. Atualmente, este
tipo de tratamento vem sendo questionado em função da
possibilidade de formação de compostos organoclorados,
que são substâncias tóxicas. 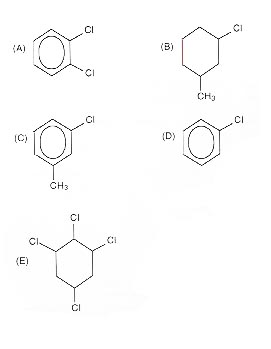
Resposta
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 Uma forma de verificar se um composto apresenta dupla ligação
carbono-carbono (C=C) é reagi-lo com soluções diluídas
de permanganato de potássio (uma solução violeta),
pois essas causam o seu descoramento. Assim, das possibilidades abaixo,
assinale aquela que contém APENAS compostos que vão
descorar uma solução diluída de permanganato de
potássio.
Resposta E) CH3CHCH2
e CH2CHCH2OH
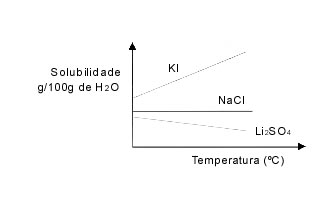
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 Observe a figura abaixo, que representa a solubilidade, em g por 100 g de H2O, de 3 sais inorgânicos numa determinada faixa de temperatura:
Assinale a afirmativa correta:
Resposta C) A solubilidade do KI é maior que as solubilidades dos demais sais, na faixa de temperatura representada. Comparando cada alternativa com o gráfico,
verifica-se que:
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30
29 Sabendo que os potenciais das semi-reações são:
Assinale a única afirmativa correta em relação
à reação espontânea que ocorre na célula:
(D) A reação é Cd2+(aq)
+ Zn(s) --> Zn2+(aq) + Cd(s).
Resposta D) A reação é Cd2+(aq) + Zn(s) ® Zn2+(aq) + Cd(s) . Examinando os potenciais de redução
das duas semi-reações, verifica-se que, nas condições
padrões, o cádmio tende a ser reduzir e o zinco a se oxidar.
Logo a reação espontânea é Cd2+(aq)
+ Zn(s) ® Zn2+(aq)
+ Cd(s) , o que corresponde ao potencial de
Questões: 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 30
Considerando-se apenas as possibilidades apresentadas, pode-se afirmar que os compostos contidos nos frascos A e B são:
Resposta A) 1-butanol e éter etílico Os dois compostos com fórmula molecular C4H10O são butanol e éter etílico. Os pontos de ebulição e de fusão mais elevados do composto do frasco A indicam a ocorrência de ligações de hidrogênio. Portanto, este deve ser o 1-butanol. No frasco B deve estar o éter etílico que não tem possibilidade de ligações de hidrogênio.
|
||||||||||||||||||||||||||||||||||||||