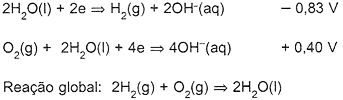|
|
|||||||||||||||||||||
|
Questões:
|
Química
- Grupo 1
1
A) A reação absorve ou desprende calor? Justifique.
B) Escreva a equação que representa a constante de equilíbrio para essa reação.
C) Em que direção a reação se deslocará se, após o equilíbrio estabelecido, ocorrer uma falha de processo e a pressão de H2O (g) diminuir? Justifique sua resposta.
Resposta A)
O sinal positivo indica que a reação é endotérmica,
isto é, a entalpia dos produtos é maior que a entalpia
dos reagentes. Portanto, a reação absorve calor.
C)
Pelo princípio de Lê Chatelier, a reação
se desloca no sentido da formação de CH4
2
A) Identifique o anodo e o catodo e calcule o potencial padrão da pilha.
B) Considerando que durante 1 hora de operação dessa pilha foram gerados 54g de água como subproduto, calcule a quantidade de mols de O2(g) injetado na pilha durante esse período.
Resposta A)
Como o potencial de redução da segunda meia reação
é mais positivo, temos que esta é a meia cela de redução;
logo a primeira meia reação tem que ser invertida por
ser uma oxidação. Assim a reação total é: O2(g) + 2H2(g)
=> 2H2O
B)
54g eqüivalem a 3 mols de H2O. Como a estequiometria
da reação é 1 mol de O2 para 2 de H2O,
seria necessária a injeção de 1,5 mols de O2(g).
valor: 3,0 pontos Dentre os compostos abaixo: I - CH3 - CH2 - CHCl - CH3 II - CH2Cl - CHCl - CH3 III - CH2 = CH2
escolha aquele que reage: A) com o Cl2 formando o 1, 2-dicloroetano.
B) com o NaOH em solução aquosa formando o 2-buteno.
C) em presença do zinco em pó formando o propino.
Em todos os três casos, escreva a reação completa.
Resposta A) O composto III reage com o Cl2 formando o 1,2 - dicloroetano
B) O composto I reage com o NaOH em solução aquosa formando o 2-buteno
C) composto II reage na presença de zinco em pó, formando o propino |
||||||||||||||||||||