|
CONSULTE
A TABELA PERIÓDICA
Questão 21
Assinale a alternativa FALSA sobre o composto H3C-COONa..
| (A) |
É um sal de ácido carboxílico. |
| (B) |
Pode ser obtido a partir da reação entre
hidróxido de sódio e ácido acético. |
| (C) |
Contém um átomo de carbono com hibridação
sp3 e outro com hibridação sp2. |
| (D) |
Seu nome oficial é etanoato de sódio. |
| (E) |
É um composto orgânico e, portanto, não
se ioniza quando em solução aquosa. |
| |
|
| Resposta: (E) É um composto
orgânico e, portanto, não se ioniza quando em solução
aquosa. |
O composto orgânico H3C-COONa
se ioniza quando em solução aquosa, segundo a reação:
H3C-COONa (s) = H3C-COO-(aq) + Na+(aq) |
Questões: 21
| 22 | 23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 22
Assinale a alternativa INCORRETA sobre a reação
não balanceada a seguir:
MnO4-(aq) + H+(aq) + Fe2+(aq)
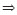 Mn2+(aq) + H2O(l) + Fe3+(aq)
Mn2+(aq) + H2O(l) + Fe3+(aq)
| (A) |
O nome oficial do ânion MnO4-é
permanganato. |
| (B) |
O ácido H+ sofre oxidação,
formando água. |
| (C) |
O número de oxidação do manganês
no permanganato é +7. |
| (D) |
O cátion Fe2+ sofre oxidação,
formando o cátion Fe3+. |
| (E) |
Os coeficientes estequiométricos dos compostos
na equação balanceada, na ordem em que se apresentam,
são: 1, 8, 5, 1, 4 e 5. |
| |
|
| Resposta: (B) O ácido H+
sofre oxidação, formando água. |
| O acido H+ participa da reação,
mas não sofre oxidação nem redução,
pois o número de oxidação do hidrogênio,
tanto no H+ quanto na H2O, é igual a 1. |
Questões: 21
| 22 | 23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 23
Considere a seguinte reação:
H2(g) + ½ O2(g)  H2O(l) + 68 kcal, H2O(l) + 68 kcal,
e assinale a alternativa FALSA
| (A) |
A reação de formação da
água é exotérmica. |
| (B) |
A reação de formação da
água apresenta DH negativo. |
| (C) |
A quantidade de calor libertada depende unicamente dos
estados inicial e final da reação. |
| (D) |
Caso fosse obtida, a partir dessa mesma reação,
água no estado gasoso, a quantidade de calor libertado também
seria 68 kcal. |
| (E) |
O fornecimento de calor a esse sistema reacional fará
com que o equilíbrio químico se desloque para o sentido
de formação dos reagentes. |
| |
|
| Resposta: (D) Caso fosse obtida,
a partir dessa mesma reação, água no estado gasoso,
a quantidade de calor libertado também seria 68 kcal. |
| Caso fosse obtida, a partir dessa
mesma reação, água no estado gasoso, a quantidade
de calor libertado seria diferente de 68 kcal, visto que o calor da
reação depende dos estados dos reagentes e dos produtos.
|
Questões: 21
| 22 | 23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 24
Considere as seguintes afirmativas:
I - Durante a mudança de estado de uma substância
pura, a temperatura se mantém constante.
II - As misturas são sistemas polifásicos.
III - Um sistema homogêneo pode apresentar mais de um componente,
mas não mais que uma fase.
e responda quais são sempre verdadeira
| (A) |
Apenas a I. |
| (B) |
Apenas a II. |
| (C) |
Apenas a III. |
| (D) |
A I e a III.. |
| (E) |
A I e II. |
| |
|
| R: Resposta: (D) A I e a III. |
| A frase II. "as misturas são
sistemas polifásicos", nem sempre é verdadeira,
pois existem misturas que são sistemas monofásicos,
ou seja, as soluções. |
Questões: 21
| 22 | 23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 25
Considerando que, em determinado local, a água pura apresenta
ponto de ebulição igual a 90 °C, assinale a alternativa
INCORRETA.
| (A) |
Esse local se encontra acima do nível do mar. |
| (B) |
A adição de uma quantidade qualquer de
NaCl certamente provocará um aumento no ponto de ebulição
da solução resultante. |
| (C) |
A pressão de vapor da água, nesse local,
é igual a 760 mmHg. |
| (D) |
A pressão máxima de vapor da água
pura em um local qualquer a 80 °C certamente será menor
que a 90 °C, independentemente do local considerado. |
| (E) |
A pressão de vapor de um líquido é
uma propriedade que depende apenas da estrutura de suas moléculas
e da temperatura em que se encontra. |
| |
|
| R: Resposta: (C) A pressão
de vapor da água, nesse local, é igual a 760 mmHg. |
| A pressão de vapor da água
não é igual a 760 mmHg, visto que seu ponto de ebulição
naquele local é 90 ºC. Para ter pressão de vapor
igual a 760 mmHg, seu ponto de ebulição deveria ser
igual a 100 ºC, ou seja, estar no nível do mar. |
Questões: 21 | 22
| 23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 26
A uréia, (NH2)2CO, foi a primeira substância
orgânica a ser sintetizada em laboratório a partir de uma
substância classificada como inorgânica (cianato de amônio),
segundo a reação mostrada a seguir:
NH4+NCO-(s) 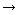 (NH2)2CO(s) (NH2)2CO(s)
Considerando que a reação tem um redimento de 80%, assinale
a alternativa que apresenta a massa de uréia obtida a partir de
0,25 mol de cianato de amônio
| (A) |
25 g |
| (B) |
12 g |
| (C) |
15 g |
| (D) |
5 g |
| (E) |
10 g. |
| |
|
| R: Resposta: (B) 12 g. |
| A uréia é formada a
partir do cianato de amônio em uma relação estequiométrica
1 para 1. Como as massas molares de ambos são iguais (60 g
mol-1), 0,25 mol (15 g) de cianato de amônio gerariam 15 g de
uréia, se a reação tivesse 100 % de rendimento.
Como a reação tem 80 % de rendimento, obtém-se
12 g de uréia. |
Questões: 21
| 22 | 23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 27
Considere uma pilha constituída por dois eletrodos formados, respectivamente,
por uma placa de cobre mergulhada em uma solução aquosa
de nitrato de cobre, Cu(NO3)2, e por uma placa de
prata mergulhada em uma solução aquosa de nitrato de prata
(AgNO3). Sabendo os potenciais padrões de redução
do cobre (+ 0,34 V) e da prata (+ 0,80), qual a reação de
oxirredução da pilha e o seu potencial padrão?
| (A) |
Cu(s) +Ag+(aq) 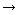 Cu+2(aq)
+Ag+(s), e + 1,26 V. Cu+2(aq)
+Ag+(s), e + 1,26 V. |
| (B) |
Cu(s) +2Ag+(aq) 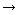 Cu+2(aq)
+2Ag(s), e + 0,46 V. Cu+2(aq)
+2Ag(s), e + 0,46 V. |
| (C) |
Cu+2(aq) +2Ag+(s) 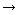 Cu+2(s)
+2Ag+(aq), e - 0,46 V. Cu+2(s)
+2Ag+(aq), e - 0,46 V. |
| (D) |
Cu+2(aq) +Ag+(s) 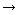 Cu+2(s)
+Ag+(aq), e - 1,26 V. Cu+2(s)
+Ag+(aq), e - 1,26 V. |
| (E) |
Cu+2(aq) + NO2(g) 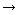 Cu+2(s)
+NO3-(aq), e - 0,2 V. Cu+2(s)
+NO3-(aq), e - 0,2 V. |
| |
|
R: Resposta: (B) Cu(s) +2Ag+(aq)
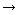 Cu+2(aq)
+2Ag(s), e + 0,46 V. Cu+2(aq)
+2Ag(s), e + 0,46 V. |
O Ag+ tem um potencial
de redução maior que o Cu2+, logo, na pilha,
os íons Ag+ são reduzidos a prata metálica,
enquanto o cobre metálico é oxidado a Cu2+.
Assim, a equação da pilha será: Cu(s) +2Ag+(aq)
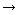 Cu2+(aq)
+2Ag(s). O potencial padrão é dado por + 0,80 - 0,34
= + 0,46 V. Considerando-se que o potencial padrão é
propriedade intensiva da matéria, este valor não deve
ser multiplicado pelo coeficiente estequiométrico. Cu2+(aq)
+2Ag(s). O potencial padrão é dado por + 0,80 - 0,34
= + 0,46 V. Considerando-se que o potencial padrão é
propriedade intensiva da matéria, este valor não deve
ser multiplicado pelo coeficiente estequiométrico. |
Questões: 21 | 22
| 23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 28
Uma certa quantidade de acetaldeído se decompõe, segundo
a reação abaixo, com uma cinética de segunda ordem
(k = 2,0 L mol-1 s-1).
C2H4O(g) 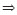 CH4(g)
+ CO(g) CH4(g)
+ CO(g)
Assinale a alternativa INCORRETA
| (A) |
Se a concentração inicial do acetaldeído
for duplicada, a reação ocorre com uma velocidade inicial
quatro vezes maior. |
| (B) |
A velocidade da reação depende da temperatura. |
| (C) |
Se a reação ocorrer em um recipiente fechado,
à temperatura constante, a pressão aumenta à
medida que a reação de formação dos produtos
ocorre. |
| (D) |
Se a concentração inicial de acetaldeído
for 0,002 mol L-1, a velocidade inicial da reação
será 0,004 mol L-1 s-1. |
| (E) |
A energia de ativação de uma reação
é a energia mínima que o(s) reagente(s) precisam para
formar os produtos, isto é, para que a reação
se inicie. |
| |
|
| Resposta: (D) Se a concentração
inicial de acetaldeído for 0,002 mol L-1, a velocidade inicial
da reação será 0,004 mol L-1 s-1. |
A velocidade da reação,
que é de primeira ordem é dada por: v = k[acetaldeído]2
Assim: v = 2,0 x (0,002)2 = 8,0 x 10-6 mol L-1. |
Questões: 21 | 22
| 23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 29
Considere 100 mL de uma solução aquosa de ácido
clorídrico preparada pela dissolução de 0,73 g de
HCl gasoso. Considere que essa solução tenha sido diluída
com água, perfazendo um volume final de 200 mL.
Assinale a alternativa que indica a molaridade e o pH dessa solução.
| (A) |
0,5 mol L-1 e 5. |
| (B) |
0,01 mol L-1 e 2. |
| (C) |
0,1 mol L-1 e 1. |
| (D) |
0,2 mol L-1 e 2. |
| (E) |
0,05 mol L-1 e 5. |
| |
|
| Resposta: (C) 0,1 mol L-1 e 1. |
A molaridade pode ser calculada diretamente
pela equação da molaridade:
M = 7,3 g/(36,5 g mol-1 x 0,1 L) = 0,2 mol L-1.
Após diluição dessa solução com
água, tem-se que a molaridade final seria
Mf = MiVi/Vf = (2 mol L-1 x 0,1 L) / 0,2 L = 0,1 mol L-1.
O pH dessa solução será 1, sendo esse valor dado
pelo inverso do logarítimo da molaridade da mesma. |
Questões: 21
| 22 | 23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 30
Assinale a alternativa INCORRETA.
| (A) |
A radiação gama consiste em partículas
compostas por dois prótons e dois nêutrons. |
| (B) |
Um átomo de fósforo (30P) tem
massa aproximada de 5 x 10-23 g. |
| (C) |
O elemento sódio (23Na11)
apresenta configuração eletrônica 1s2
2s2 2p6 3s1, forma hidróxido
solúvel quando reage com a água e é mais eletropositivo
que o elemento potássio. |
| (D) |
O peso atômico de um elemento químico natural
é dado pela média ponderada das massas de cada um dos
isótopos naturais desse elemento químico, considerando
as respectivas abundâncias relativas. |
| (E) |
Uma mistura contendo 0,1 mol de cada um dos gases H2,
O2 e CO2 ocupa um volume de 6,72 L nas CNTP. |
| |
|
| Resposta: QUESTÃO
ANULADA! |
Questões: 21 | 22
| 23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
|
