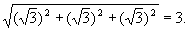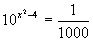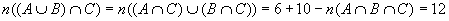|
| Questão 01 (1,0 ponto) |
|
Um jogador de futebol em repouso vê uma bola passar por ele a uma velocidade constante de 5 m/s. Ele sai em perseguição da mesma com uma aceleração constante igual a 1,0 m/s 2.
a) Em quanto tempo ele alcançará a bola?
b) Qual a distância percorrida por jogador e bola, quando o jogador finalmente alcançar a bola? |
|
Respostas:
a) Quando ele alcançar a bola 5 t = ½ 1,0 t2 → t = 10 s.
b) Em 10 s a bola e o jogador percorrem 10 s x 5 m/s = 50 m. |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
| Questão 02 (1,0 ponto) |
|
Cinco resistores idênticos, de resistência R = 100 Ω, estão colocados como na figura, ligados por condutores aos pontos A, B, C e D. Uma tensão de 120 V é aplicada nos terminais A e B.
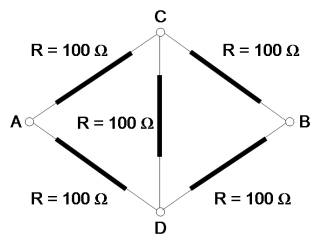
a) Calcule a diferença de tensão entre os pontos C e D.
b) Calcule a diferença de tensão entre os pontos A e C. Calcule a corrente no resistor que conecta A e C.
c) Calcule a corrente total que passa entre A e B.
|
|
Respostas:
a) Por simetria a diferença de tensão entre os terminais C e D deve ser nula.
b) A diferença de tensão entre A e C deve ser a metade daquela entre A e B dado que a diferença de tensão entre C e B deve ser a mesma que entre A e C. Assim ambas devem ser metade da diferença de tensão entre A e B. Ou seja, a diferença de tensão entre A e C é de 60 V. Como VAC = R iAC → iAC = VAC / R = 60 / 100 = 0,60 A.
c) A corrente pelo ramo ACB deve ser a mesma que pelo ramo ADB. Portanto a corrente total deve ser 2 x 0,60 = 1,20 A.
|
Questões: 01
| 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 |
demais provas
| Questão 03
(1,0 ponto) |
|
Um gás ideal possui um volume de 100 litros e está a uma temperatura de 27 oC e a uma pressão igual a 1 atm (101000 Pa). Este gás é comprimido a temperatura constante até atingir o volume de 50 litros.
a) Calcule a pressão do gás quando atingir o volume de 50 litros.
O gás é em seguida aquecido a volume constante até atingir a temperatura de 627 ºC.
b) Calcule a pressão do gás nesta temperatura. |
|
|
Respostas:
a) A temperatura constante, P1 V1 = P2 V2 → P2 = P1 V1 / V2 = 1 x 100 / 50 = 2 atm.
b) A volume constante, P1 / T1 = P2 / T2 → P2 = P1 T2 / T1 = 2 x (627 + 273)/(27 + 273) = 2 x 900 / 300 = 2 x 3 = 6 atm. |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
| Questão 04
(1,0 ponto) |
|
| Sejam os pontos A = (a, 1) e B = (0, a). Sabendo que o ponto médio do segmento AB pertence à reta x + y = 7, calcule o valor de A. |
R: Seja P o ponto médio de AB. Logo P = ( 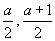 ) e se pertence à reta temos ) e se pertence à reta temos 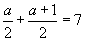 . Então a = 6,5. . Então a = 6,5. |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
| Questão 05 |
|
| Dois dados não viciados são jogados simultaneamente. Qual a probabilidade da soma ser 7 nessa jogada? |
R: Temos um total de 36 possibilidades para dois dados (6 ´ 6). Para a soma ser sete temos 6 casos possíveis.
Logo, a probabilidade é 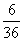 ou seja ou seja 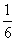 . . |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
| Questão 06 |
|
Calcule a maior distância entre dois pontos de um cubo de aresta 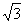 cm. cm. |
R: A maior distância é: 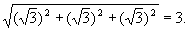 |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
Questão 07
|
|
Determine uma das soluções da equação 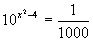 |
| R: Temos que x2 - 4 = 3. Logo x = 1 ou x = -1 |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
| Questão 08 |
|
Se A, B e C são três conjuntos onde n (A) = 25, n (B) = 18, n (C) = 27, n (A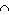 B) = 9, n (B B) = 9, n (B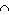 C) = 10, n (A C) = 10, n (A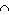 C) = 6 e n (A C) = 6 e n (A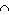 B B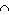 C) = 4, (sendo n (X) o número de elementos do conjunto X), determine o valor de n ((A C) = 4, (sendo n (X) o número de elementos do conjunto X), determine o valor de n ((A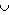 B) B)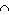 C). C). |
R: 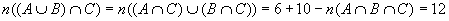 |
uestões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
| Questão 09 |
|
Considere a reação abaixo:
CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g)
a) Ao reagir 11,9 g de CHCl3 em um ambiente contendo gás cloro em excesso, qual a massa de CCl4(g) e de HCl(g) produzida se a reação apresentar 75 % de rendimento?
b) Quais os nomes das substâncias CHCl3 e CCl4 segundo a IUPAC?
c) Que tipo de ligação química existe entre os átomos de H e de Cl na molécula de HCl?
|
|
Respostas:
a) 11,9 g de CHCl3 correspondem a 0,1 mol, que, ao reagir, produz 0,075 mol de HCl e 0,075 mol de CCl4, considerando-se o rendimento de 75 %. Esses valores equivalem a, aproximadamente, 2,74 g de HCl, e 11,55 g de CCl4
b) CHCl3: triclorometano, e CCl4: tetraclorometano
c) Ligação covalente polar |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
| Questão 10 |
|
O processo Haber-Bosch, um dos mais utilizados para a obtenção de amônia sintética, conforme reação dada abaixo, utiliza temperatura na faixa de 550 ºC e pressão de 200-300 atm.
Fe
N2(g) + 3 H2(g) → 2 NH3(g) D H (25 ºC) = - 22,04 kcal/mol de N2 reagido
Sabendo disso, pergunta-se:
a) Qual a função do Fe nessa reação?
b) Qual o valor da entalpia padrão da amônia a 25 ºC. Explique sua resposta.
c) O que deve acontecer com o equilíbrio dessa reação caso a mesma seja realizada em:
I) Temperaturas maiores que 550 ºC? Explique sua resposta.
II) Pressões maiores que 200 atmosferas? Explique sua resposta.
|
|
Respostas:
a) O Fe atua como catalisador da reação.
b) A entalpia padrão da amônia a 25 ºC vale -11,02 kcal mol -1. Explicação: como o valor da entalpia padrão de substâncias simples é zero, o ∆H da reação a 25 ºC é duas vezes o valor da entalpia padrão da amônia.
c)
i- Uma vez que a reação de formação de amônia (reação direta) é exotérmica, pelo Princípio de Le Chatelier, um aumento na temperatura desloca o equilíbrio termodinâmico da reação para o sentido da reação endotérmica, ou seja, para a formação de reagentes (N2 e H2) (reação inversa).
ii- Também pelo princípio de Le Chatelier, um aumento da pressão desloca o equilíbrio termodinâmico para o sentido da reação envolvendo uma diminuição no número de mols, ou seja, desloca o equilíbrio para o sentido da reação direta (de formação de amônia). |
Questões: 01 | 02 | 03 04 | 05 | 06 | 07 | 08 | 09 | 10 | demais provas
|


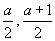 ) e se pertence à reta temos
) e se pertence à reta temos 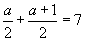 . Então a = 6,5.
. Então a = 6,5. 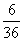 ou seja
ou seja 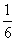 .
. 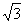 cm.
cm.