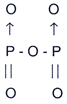|
 QUÍMICA
(objetiva) - grupo 3 QUÍMICA
(objetiva) - grupo 3
Prova realizada no dia 11/12//2003
________________________________________________________________________________________
CONSULTE
A TABELA PERIÓDICA
Questão 21
Considere as seguintes afirmativas:
I) O elemento químico que possui configuração
eletrônica 1s2 2s2 2p6 3s2
3p6 4s2 faz parte do grupo dos elementos alcalinos,
e seu número de oxidação mais comum é +1.
II) Um elemento da família dos alcalinos reage com água
para formar o respectivo hidróxido.
III) Um par de isótopos possui o mesmo número de massa,
porém números atômicos diferentes.
IV) O íon mais comum do elemento Br é formado pela perda
de um elétron.
V) Uma partícula a
é formada por dois prótons e dois nêutrons. Um nuclídeo
que emite uma partícula a
resulta em um novo nuclídeo com duas unidades de número
atômico e duas unidades de número de massa menores que o
do nuclídeo original.
Com base nas afirmativas acima, pode-se concluir que:
(A) apenas a afirmativa II é correta.
(B) as afirmativas I, II e V são corretas.
(C) apenas a afirmativa IV é correta.
(D) as afirmativas II e V são corretas.
(E) todas as afirmativas são falsas.
R: (A)
apenas a afirmativa II é correta.
O item A é o correto pois apenas a afirmativa II é
correta. A configuração 1s2 2s2 2p6
3s2 3p6 4s2 é de um elemento da
família dos alcalinos terrosos. Um par de isótopos possui
mesmo número atômico, porém números de massa
diferentes. O íon mais comum do elemento Br é o Br¯
que é formado pelo ganho de um elétron. Um nuclídeo
que emite uma partícula resulta em um novo nuclídeo com
duas unidades de número atômico e quatro unidades de número
de massa menores que o do nuclídeo original.
Questões: 21
| 22 |23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 22
O sulfato de bário (BaSO4) é
usado como contraste em exames radiológicos e pode ser obtido pela
seguinte reação:
BaCl2(aq) + H2SO4(aq)
=> BaSO4(s) + 2HCl(aq)
Que volume de solução aquosa de ácido
sulfúrico (H2SO4) 1,5 mol L-1 deve
ser utilizado para se obter 30 mols de BaSO4? Considere que
existe excesso de BaCl2.
(A) 6 L
(B) 12 L
(C) 15 L
(D) 20 L
(E) 25 L
R: (D) 20 L
O volume necessário para produzir 30 mols de BaSO4(s)
pode ser calculado por V = n/M = 30 mols/1,5 mol L-1 = 20 L.
A resposta correta é a alternativa D.
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 23
A queima da glicose (Reação I) é
a principal fonte de energia dos seres vivos aeróbicos. O LiOH
pode ser usado para absorver o CO2 liberado pela reação
da glicose com oxigênio. Quantos mols de LiOH são necessários
para absorver todo o CO2 (Reação II) liberado
por um indivíduo diariamente, sabendo que o mesmo precisa de 3400
kJ por dia de energia?
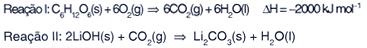
(A) 2,4 mols
(B) 5,1 mols
(C) 10,2 mols
(D) 12,2 mols
(E) 20,4 mols
R: (E) 20,4 mols
Se são necessários 3400 kJ de energia para o indivíduo,
conclui-se que são precisos 1,7 mol de glicose, pois cada mol fornece
2000 kJ de energia. Mas, como cada mol de glicose gera 6 mols de CO2
temos que 1,7 mol de glicose forneceria 10,2 mols de CO2 que
devem ser absorvidos por 20,4 mols de LiOH, desde que cada mol de CO2
precisa de 2 mols de LiOH. A resposta correta é a E.
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 24
Um ácido carboxílico RCOOH se dissocia em solução
aquosa segundo a reação abaixo.
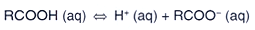
Se uma solução 0,1 mol L-1 desse
ácido é 10% dissociada, qual o valor do pH da solução?
| (A) pH = 1 |
(B) pH = 2 |
| (C) pH = 7 |
(D) pH = 12 |
| (E) pH = 13 |
|
R: (B)
pH = 2
Se os 10 % do ácido se dissocia em solução, temos
0,01 mol L-1 de H+ (aq) + RCOO- (aq)
em equiliíbrio com (0,1 - 0,01) ou 0,09 mol L-1 do ácido
não dissociado. Assim, o pH da solução é igual
a log (1/0,01) ou igual a 2. A resposta correta é a B.
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 25
Assinale a alternativa INCORRETA.
(A) O propanal e a propanona são isômeros
funcionais.
(B) O ácido salicílico (HO-C6H4-COOH)
é um composto aromático onde se podem identificar as funções
orgânicas fenol e ácido carboxílico.
(C) Os estereoisômeros não são isômeros estruturais
e diferem somente pelo arranjo de seus átomos no espaço.
(D) A existência de isômeros ópticos ocorre somente
em compostos que possuem pelo menos um carbono quiral.
(E) O ciclohexano é um composto orgânico aromático
com 6 carbonos.
ATENÇÃO: Questão 25 Anulada.
Questões: 21
| 22 |23 | 24
| 25 | 26
| 27 | 28 | 29
| 30 | demais
provas
Questão 26
No composto P2O5, nas ligações
P-O, o número de ligações covalentes dativas é:
(A) 1 (B) 2 (C) 3 (D)
4 (E) 5
R: (B) 2
O fósforo tem 5 elétrons,
e o oxigênio tem 6 elétrons na última camada, respectivamente.
Portanto, para obedecer à regra do octeto, sua fórmula estrutural
é:
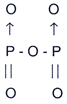
A resposta correta é a B pois são
duas as ligações covalentes dativas.
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 27
Dada a reação:
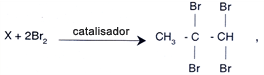
conclui-se que o composto X é:
| (A) CH2=CH-CH3 |
(B) CH2=CH2 |
| (C) CH3-CºCH
|
(D) CH3-CH2-CºCH |
| (E) CH3-CH2-CH3 |
|
R: (C)
CH3-CºCH
Dentre os compostos acima somente o composto C reage com o bromo
na presença de catalisador para dar o composto
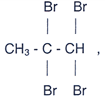
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 28
Queimando-se um saco de carvão de 3 kg, numa churrasqueira,
com rendimento de 90%, quantos quilogramas de CO2 são
formados?
(A) 2,7 B) 3,0 (C) 4,4
(D) 9,9 (E) 11
R: (D) 9,9

Por tanto, a resposta correta é a D.
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 29
A fórmula mínima de um composto orgânico é
(CH2O)n. Sabendo-se que o peso molecular desse composto
é 180, qual o valor de n?
(A) 2 (B) 4 (C) 6 (D) 8 (E)
12
R: (C) 6
Se a fórmula mínima do composto é (CH2O)n,
tem-se que:
(12 + 2.1 + 16)n = 180.
Logo, n = 180 / 30 = 6
A resposta correta é a C.
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
Questão 30
Escolha, entre as substâncias abaixo, aquela que tem as seguintes
propriedades: não conduz a corrente elétrica no estado sólido,
mas conduz em solução e é solúvel em solventes
polares.
(A) NaCl (B) Na (C) HCl (D) Cl2
(E) H2
R: (A) NaCI
O NaCl é o único composto da lista que não conduz
a corrente elétrica no estado sólido, conduz em solução
e é solúvel em solventes polares. O Na conduz a corrente
no estado sólido, o HCl e o Cl2 e o H2 não
existem no estado sólido. Portanto, a resposta correta é
a A.
Questões: 21 | 22
|23 | 24 | 25
| 26 | 27
| 28 | 29 | 30
| demais provas
|