
|
09/07/2004
|
10/07/2004
|
|||
| TEOLOGIA | TODOS OS CURSOS | TODOS OS CURSOS, exceto INFORMÁTICA | apenas INFORMÁTICA | |
| DISCURSIVAS | Redação e Língua Portuguesa e Literatura Brasileira | Geografia e História | Física, Matemática e Química | |
| OBJETIVAS | Espanhol e Inglês | Biologia, Física, Matemática e Química | Biologia, Geografia e História | |
|
Questões:
|
|
![]() CONHECIMENTOS
GERAIS - FÍSICA, MATEMÁTICA E QUÍMICA- apenas para
Informática
CONHECIMENTOS
GERAIS - FÍSICA, MATEMÁTICA E QUÍMICA- apenas para
Informática
Prova discursiva realizada no dia 10/07/2004
Um recipiente termicamente isolado contêm 100 g de gelo a 0 Co
e 200g de água a 70 Co . O calor latente de fusão do gelo
é L = 80 cal/g e o calor específico da água é
c = 1,0 cal/(g Co ).
a) Qual o
calor necessário para fundir todo o gelo?
Resposta:
O calor
necessário para fundir todo o gelo é Q=100 x 80 = 8000 cal.
Este calor será cedido pela água e esta descera
.![]()
b) Qual a
temperatura final de equilíbrio do sistema gelo + água?
Resposta:
A temperatura
final será dada por ![]()
Questões: 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | topo da página
Um corredor percorre o primeiro quilômetro de sua corrida com uma
velocidade de 5m/s e o segundo quilômetro com a velocidade de 2,5
m/s.
a) Qual o
tempo necessário para o corredor percorrer os dois trechos da corrida?
Resposta:
O tempo necessário para percorrer o primeiro quilômetro é t1= 1000/5 = 200s, e para o segundo quilômetro é t2 = 1000/2,5 = 400s. O tempo total é T = 200 + 400 = 600 s = 10 min.
b) Desprezando
a resistência do ar, calcule a velocidade média do corredor,
para toda a corrida (em m/s).
Resposta:
A velocidade
média será a distância total dividida pelo tempo total,
ou seja, a velocidade média do corredor é dada por
![]()
Questões: 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | topo da página
Duas cargas positivas (de magnitudes Q = 1,0 C e 2Q = 2,0 C) distam de
4,0 m, ao longo do eixo x, sendo que a carga maior está à
direita da carga menor. Exatamente no ponto médio entre elas, está
colocada uma carga negativa - 0,5 C.
a) Em que direção e sentido aponta a força resultante sobre a carga negativa?
Resposta:
A força resultante aponta na direção da carga maior dado que a forca é atrativa entre a carga negativa e as positivas. O sentido é da esquerda para a direita.
b) Qual é o módulo da força resultante sobre a carga negativa? (em função da constante de Coulomb, K)
Resposta:
O modulo é K(1,0) x (-0,5)/2,02- K(2,0) x (-0,5)/2,02 = 0,125K N, onde K é a constante de Coulomb.
Questões: 01
| 02 | 03 | 04
| 05 | 06 | 07
| 08 | 09 | 10
| topo da página
Por uma conta de telefone atrasada foram pagos R$164,80. Sabendo-se que
a taxa de multa por atraso cobrada sobre o valor desta conta foi de 3%,
calcule:
a) o valor da conta sem a multa.
Resposta:
Seja
C o valor da conta. Temos que, 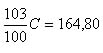 logo
103C=16480, donde C = 160.
logo
103C=16480, donde C = 160.
b) o valor da multa.
Resposta:
O valor da multa é 164,80 -160,00= 4,80
Questões:
01
| 02 | 03 | 04
| 05 | 06 | 07
| 08 | 09 | 10
| topo da página
Numa cobrança de falta, a altura (em metros) da bola t segundos
após o chute é dada pela fórmula:
altura =![]()
Determine:
a) o valor de t que corresponde à altura máxima da bola.
Resposta:
![]() =
0 para t = 0 e t = 3. Logo o valor de t procurado
é
=
0 para t = 0 e t = 3. Logo o valor de t procurado
é ![]()
b) esta altura máxima.
Resposta:
A altura
máxima é ![]()
Questões: 01
| 02 | 03 | 04
| 05 | 06 | 07
| 08 | 09 | 10
| topo da página
Uma escada encostada num muro faz um ângulo de
30° com o muro e a distância entre a base da escada e o muro
é de 1,5 metros. A escada é recolocada de tal maneira que
a altura do topo da escada é de 1,5 metros acima do chão.
Qual o ângulo que a escada faz com o muro depois de recolocada?
Resposta:
O
comprimento da escada é de ![]() ,
ou seja, 3 metros. Se
,
ou seja, 3 metros. Se![]() é o ângulo entre a escada e o chão (depois de recolocada),
então
é o ângulo entre a escada e o chão (depois de recolocada),
então ![]() .
Logo,
.
Logo,![]() =300
donde o ângulo entre a escada e o muro é de 60°.
=300
donde o ângulo entre a escada e o muro é de 60°.
Questões: 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | topo da página
Qual a probabilidade de um número entre 1 e 300 escolhido ao acaso ser múltiplo de 15 e 20 ao mesmo tempo?
Resposta:
Ser
múltiplo de 15 e 20 ao mesmo tempo equivale a ser múltiplo
do MMC (15, 20), ou seja de 60. Como tem 5 múltiplos de 60 entre
1 e 300 a probabilidade é de ![]() ,
ou seja
,
ou seja ![]()
Questões: 01
| 02 | 03 | 04
| 05 | 06 | 07
| 08 | 09 | 10
| topo da página
Um terreno de 120 m2 contém uma piscina de 6 m x 8m. A calçada ao redor da piscina tem largura x conforme a figura. Calcule o valor de x em metros.
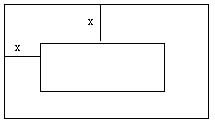
Resposta:
(6+2x)
X (8+2x) = 120. Logo donde 4x2+28x+48
= 120 donde x2 + 7x - 18=0 ou seja x =2
ou x = -9. Como x tem que ser positivo, x= 2.
Questões: 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | topo da página
Um dos métodos de obtenção de gás cloro em
laboratório é pela reação de uma solução
aquosa de ácido clorídrico 6 mol L-1 com dióxido
de manganês, segundo a reação:
4 HCl (aq) + MnO2 (s )![]() Cl2 (g) + MnCl2 (aq) + 2 H2O (l)
Cl2 (g) + MnCl2 (aq) + 2 H2O (l)
Pergunta-se:
a) qual o volume da solução de HCl 6 mol L-1 necessário para reagir com 26,1 g de MnO2 puro?
Resposta:
Massa
molar do MnO2 = 55 + 16 +16 = 87 g
Sabendo que: 1 mol de MnO2 contém 87 g
então, x mol contém 26,1 g. Portanto, x = 0,3 mol.
Pela reação, sabe-se que: 4 mols de HCl reagem com 1 mol
de MnO2.
Então: y mol de HCl reagirão com 0,3 mol de MnO2.
Portanto, y = 1,2 mol.
Como a solução de HCl é 6 mol L-1, então:
1 litro da solução contém 6 mols de HCl. Portanto,
z litros da solução conterão 1,2 mol de HCl. Assim,
z= 0,2 L
b) qual o número de oxidação do cloro no HCl e no Cl2, e do manganês no MnO2 e no MnCl2?
Resposta:
Número
de oxidação:
do cloro: no HCl = -1 em no Cl2 = zero
do manganês: no MnO2 = +4, e no MnCl2 = +2
c) qual o volume de gás cloro (Cl2), em litros, formado nas CNTP (condições normais de temperatura e pressão), quando 26,1 g de MnO2 puro reage completamente com solução de HCl?
Resposta:
26,1
g de MnO2 correspondem a 0,3 mol.
Assim, pela reação, sabe-se que 1 mol de MnO2 forma 1 mol
de Cl2. Portanto,
0,3 mol de MnO2 formará 0,3 mol de Cl2.
Sabendo-se que, nas CNTP, um mol de qualquer gás ocupa 22,4 litros,
então:
1 mol de Cl2 ocupa 22,4 L
0,3 mol ocupará 6,72 L
Questões: 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | topo da página
O ácido fórmico (HCOOH) e a anilina (C6H5NH2) são
exemplos de ácido fraco e base fraca, respectivamente.
a) Quais os
nomes dessas duas substâncias segundo a IUPAC ?
Resposta:
a) ácido metanóico e aminobenzeno
b) Escreva
a expressão da constante de equilíbrio do ácido fórmico
em água e calcule a constante de equilíbrio desse ácido,
sabendo que, a uma certa temperatura, uma solução aquosa
de 0,1 mol L-1 de ácido fórmico está 2
% dissociado.
Resposta:

c) Escreva a equação de equilíbrio de dissociação da anilina em água.
Resposta:
![]()
Questões: 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | topo da página